Lý thuyết: Biến thiên enthalpy trong số phản xạ hóa học
I. Phản ứng lan sức nóng, phản xạ thu nhiệt
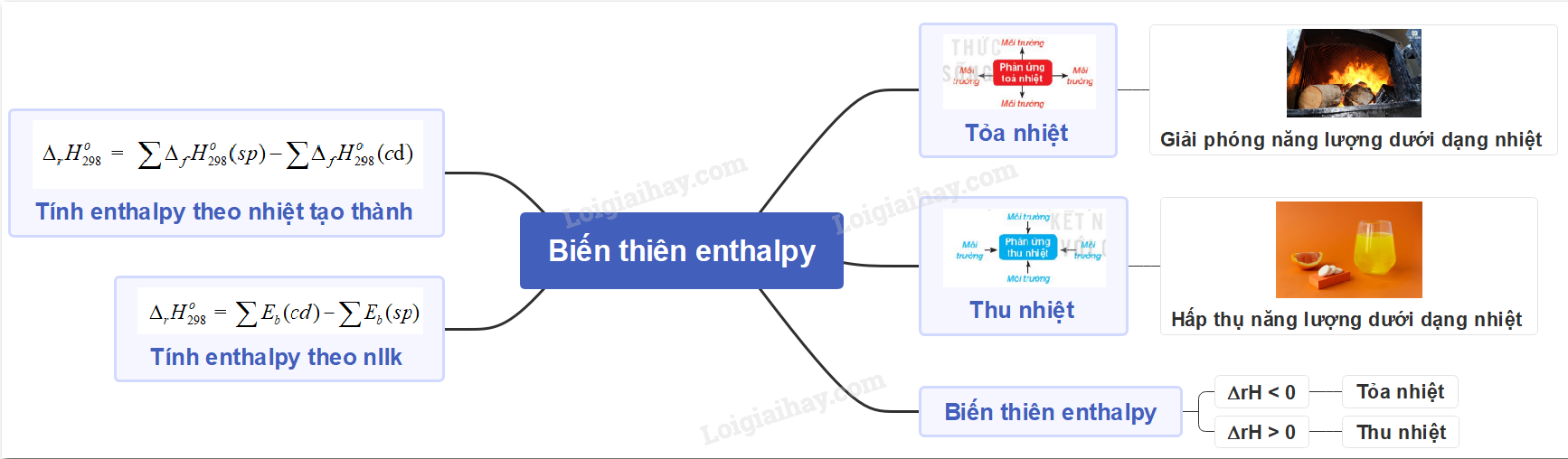
- Phản ứng lan sức nóng là phản xạ giải tỏa tích điện bên dưới dạng nhiệt
- Phản ứng thu sức nóng là phản xạ hít vào tích điện bên dưới dạng nhiệt
Ví dụ
- Phản ứng lan nhiệt: Đốt than vãn, củi nhằm bầu không khí xung xung quanh rét hơn

- Phản ứng thu nhiệt: Pha viên sủi Vi-Ta-Min C nhập nước, thấy nước nhập ly non hơn

II. Biến thiên enthalpy của phản ứng
1. Biến thiên enthalpy
- Khái niệm: Biến thiên enthalpy của phản xạ (nhiệt phản ứng) là sức nóng lượng lan đi ra hoặc thu nhập của phản xạ ở ĐK áp suất ko thay đổi. Kí hiệu: ∆rH
- Phương trình chất hóa học tất nhiên tình trạng của những hóa học và độ quý hiếm ∆rH gọi là phương trình sức nóng hóa học
Ví dụ: Phản ứng nhen cháy 2 mol khí hydrogen vày 1 mol khí oxygen, tạo nên trở thành 2 mol nước ở tình trạng lỏng, lan đi ra sức nóng lượng 571,6 kJ.. Phản ứng bên trên đem biến thiên enthalpy \({\Delta _r}H_{298}^o\) = -571,6 kJ, màn trình diễn như sau:
2H2(g) + O2(g) → 2H2O(l) \({\Delta _r}H_{298}^o\) = -571,6 kJ
2. Biến thiên enthalpy chuẩn
- Khái niệm: Biến thiên enthalpy chuẩn chỉnh là sức nóng lan đi ra hoặc thu nhập của phản xạ được xác lập ở ĐK chuẩn: áp suất 1 bar (đối với hóa học khí), độ đậm đặc 1 mol/L (đối với hóa học tan nhập dung dịch) và sức nóng phỏng thông thường được lựa chọn là 25oC (298 K), kí hiệu \({\Delta _r}H_{298}^o\)
3. Ý nghĩa của biến thiên enthalpy
∆rH > 0: phản xạ thu nhiệt
∆rH < 0: phản xạ lan nhiệt
- Giá trị vô cùng của biến thiên enthalpy càng rộng lớn thì sức nóng lượng lan đi ra hoặc thu nhập của phản xạ càng nhiều
Ví dụ: Xét 2 phản ứng
CH4(g) + 2O2(g) CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^o\) = -890 kJ/mol
CH3OH(l) + 3/2 O2(g) CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^o\) = -726 kJ/mol
=> Đốt 1 mol methane lan đi ra sức nóng lượng nhiều hơn thế nhen 1 mol methanol
- Các phản xạ xẩy ra ở sức nóng phỏng chống thông thường là phản xạ lan sức nóng, những phản xạ thu sức nóng thông thường xẩy ra khi đun nóng
III. Tính biến thiên enthalpy của phản xạ theo dõi sức nóng tạo nên thành
1. Khái niệm sức nóng tạo nên thành
- Nhiệt tạo nên trở thành (∆fH) của một hóa học là biến thiên enthalpy của phản xạ tạo nên trở thành 1 mol hóa học bại liệt kể từ những đơn hóa học ở dạng bền vững và kiên cố nhất, tại 1 ĐK xác định
- Nhiệt tạo nên trở thành chuẩn chỉnh (\({\Delta _f}H_{298}^o\)) là sức nóng tạo nên trở thành ở ĐK chuẩn
- Nhiệt tạo nên trở thành chuẩn chỉnh của những đơn hóa học ở dạng bền vững và kiên cố nhất = 0. \({\Delta _f}H_{298}^o\)(O2(g)) = 0 kJ/mol
2. Tính biến thiên enthalpy của phản xạ theo dõi sức nóng tạo nên thành
- Biến thiên enthalpy của phản xạ được xác lập vày hiệu số đằm thắm tổng sức nóng tạo nên trở thành những hóa học thành phầm (sp) và tổng sức nóng tạo nên trở thành của những hóa học đầu (cđ)
- Tại ĐK chuẩn:
\({\Delta _r}H_{298}^o\) = \(\sum {{\Delta _f}H_{298}^o} (sp) - \sum {{\Delta _f}H_{298}^o} (c{\rm{d}})\)
- Lưu ý: Hệ số của những hóa học nhập phương trình hóa học
Ví dụ: Xác toan biến thiên enthalpy của phản xạ sau ở ĐK chuẩn:
4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g)
biết sức nóng tạo nên trở thành \({\Delta _f}H_{298}^o\) của những hóa học FeS2(s), Fe2O3(s) và SO2(g) thứu tự là -177,9 kJ/mol, -825,5 kJ/mol và -296,8 kJ/mol
Lời giải:

IV. Tính biến thiên enthalpy của phản xạ theo dõi tích điện liên kết
- Phản ứng chất hóa học là quy trình đánh tan những links nhập hóa học đầu và tạo hình những links mới mẻ muốn tạo trở thành sản phẩm
- Biến thiên enthalpy của phản xạ (mà những hóa học đều ở thể khí), vày hiệu số đằm thắm tổng tích điện links của những hóa học đầu và tổng tích điện links của những thành phầm (ở nằm trong ĐK sức nóng phỏng và áp suất)
- Tại ĐK chuẩn
\({\Delta _r}H_{298}^o\) = \(\sum {{E_b}} (cd) - \sum {{E_b}} (sp)\)

Sơ đồ dùng tư duy: